Broad研究所公布两大研究成果,共同提高CRISPR编辑的精准度
两项研究成果都为遗传研究和治愈疾病开辟了新的道路。
美国东部时间10月25日,《Science》和《Nature》两大权威杂志上先后公布了两项关于CRISPR-Cas9技术的最新研究成果,引起了科学界广泛的轰动。

渊源:CRISPR
在生物进化过程中,CRISPR是细菌在与病毒斗争的过程中产生的免疫武器,换言之,病毒会将自己的基因整合到细菌上,然后利用细菌的细胞工具为自己的基因复制服务,而细菌为了将病毒的外来入侵基因清除,就进化出了CRISPR系统。利用这个系统,细菌可以不动声色地将病毒的基因从自己的染色体上切除。
受自然界细菌的CRISPR系统启发,科学家利用蛋白Cas9实现了对DNA序列的切除操作,极大地简化了DNA编辑过程,故而这项名为CRISPR-Cas9的基因组编辑技术迅速成为生命科学中最热门的技术。
随后基于CRISPR-Cas9开发出的CRISPR工具包跃升为生物学研究新宠,它与ZFN、TALEN并列称为三大基因编辑工具。CRISPR操作简单,研究人员能更快、更经济地实现基因组特定位点的编辑。
研究成果之一:碱基编辑
在发表于《Nature》的论文中,哈佛大学化学教授、Broad Institute的研究员David Liu改进了原有的CRISPR-Cas9基因组编辑技术,开创了碱基编辑技术,此次,他成功的将单碱基A转换为G,实现了“点”修改,将碱基编辑技术带入了一个更高的精准度上。

人类的许多疾病追根溯源是由单一碱基的突变引起的,而CRISPR-Cas9基因组技术难以有效得纠正这些所谓的“点突变”,因此David Liu致力于实现高精度的基因编辑技术。
通常,CRISPR编辑使用的是gRNA和称为核酸酶的酶(最常见的是Cas9),然后将它们一起连接到特定的DNA碱基区域,随后核酸酶就会剪切双螺旋。当细胞修复机制尝试重新加入切割的DNA末端,会偶尔插入或删除碱基,有时这会使重要的碱基区域排序变成“乱码”,甚至会不小心删掉靶基因。对此,美国马萨诸塞州剑桥大学研究所的研究员冯章研究员表示:“核酸基因编辑非常适合灭活基因,不过编辑的准确率较低。”
原先的CRISPR-Cas9技术是通过基因组的靶位点切割双链DNA来进行操作,与之不同的是,研究团队的碱基编辑技术不会削减双链DNA的双螺旋结构,他们是利用酶来实现对部分构成DNA或RNA的四个碱基的重新排列,而不改变周围的碱基。
研究团队将gRNA与“死”的Cas9(失去活性的Cas9,又称dCas9)融合,并开发了TadA酶(一种来自大肠杆菌的酶),其中,这种酶可以将碱基A转换为I,随后在细胞修复或DNA复制本身的过程将I改变为G,实现了对碱基的精准定位和修改。
研究成果二:RNA编辑
在《Science》的新论文中,由Broad Institute生物工程师张峰领导的研究团队描述了另一种实现类似于上面转换过程的方法,不过这一次不是在DNA中实现,而是通过编辑RNA来实现对蛋白质中的碱基进行定向编辑。

他的团队实现RNA编辑所用的是一种天然存在的酶,这种酶可将A中的原子重新排列成与I相似的原子。在研究过程中,研究人员通过将这种天然酶与另外一种被称为Cas13的RNA靶向酶结合,而不是使用通常的DNA结合Cas9来完成编辑。在序列特异性指导RNA分子的帮助下,他们在23-35%的时间内成功纠正了致病突变,且实验过程中发生非靶向活动的发生率也很低。
此外,该小组通过使用蛋白质工程使细菌细胞进行七次演化,以产生一种可识别和可操纵DNA的酶。该酶能够重新排列腺嘌呤中的原子,将其转化为I(细胞以G的形式读取),随后,该系统诱发细胞将胞嘧啶插入未修饰的DNA链中。
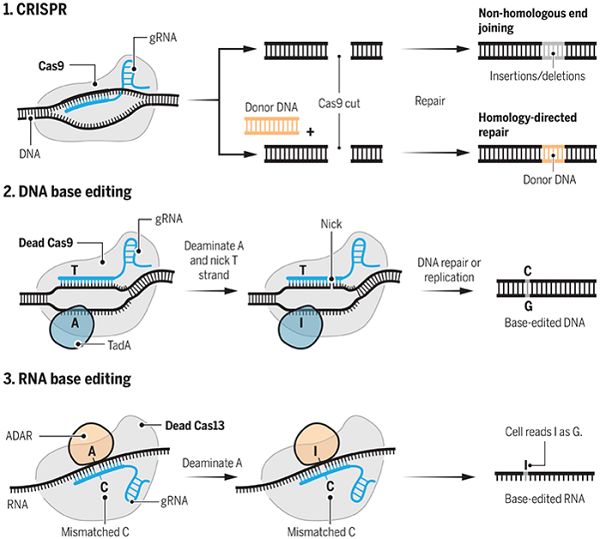
张峰团队的这种手段可用于临时校正致病突变,但却不会永久改变基因组,因此当涉及基因治疗时,这种方法更为安全;同时由于无法永久改变基因组,所以采用这种方法可能要进行多次治疗;此外,通过对该种疾病的逐步了解,研究人员可以不断改良优化RNA疗法,这也是它的优点之一。
目前,除了由A到G的转化外,其余几种对基础嘌呤嘧啶进行编辑的酶在自然界中均未发现,但刘峰先生表示“我们会继续努力,直到团队开发出所有可能进行编辑的酶”。
总结
这两项研究中一项扩展了编辑DNA的方法种类,另一项在RNA编辑方面取得了新成果,都为扩大CRISPR的影响力助力,并且为遗传研究和治愈疾病开辟了新的道路。
最后,记得关注微信公众号:镁客网(im2maker),更多干货在等你!
硬科技产业媒体
关注技术驱动创新
 基因工程
基因工程 
 微信ID:im2maker
微信ID:im2maker 长按识别二维码关注
长按识别二维码关注