疫苗研制关键突破:西湖大学再发布复合物结构,《Science》上线S蛋白结构论文
病毒入侵人体的神秘面纱终于被揭开了。
研制出新冠肺炎的疫苗,无疑将是一个漫长的过程,而在这一过程中,科学家们首先需要迈过去的“坎”就是要弄明白新冠病毒表面蛋白(S蛋白)与人体细胞受体(ACE2蛋白)的结构,以及病毒侵入后的复合物结构(两种蛋白质结合过程)。
今天(2月21日),在BioRxiv上,西湖大学又发布了关于新冠肺炎的最新研究成果,揭示了病毒侵入人体细胞后的复合物结构。
(BioRxiv论文地址:https://www.biorxiv.org/content/10.1101/2020.02.19.956946v1)
在短短十天时间内,我们相继看见了S蛋白结构、ACE2蛋白结构的研究成果,以及基于两项成果发布的复合物结构,这为后期的疫苗研制奠定了非常坚实的基础。
西湖大学发布复合物结构,揭开新冠病毒入侵人体的神秘面纱
新型冠状病毒感染人体细胞的关键在于冠状病毒的S蛋白与人体ACE2蛋白的结合。简单来说,是S蛋白“劫持”了原本用于控制血压的ACE2,通过与它的结合入侵人体。
基于此前美国Jason S. McLellan团队研究的S蛋白结构和自己研究出的ACE2蛋白结构,周强实验室进一步解析出ACE2全长蛋白与新冠病毒S蛋白受体结合结构域的复合物结构,整体分辨率2.9埃,其中S蛋白RBD部分的分辨率为3.5埃。
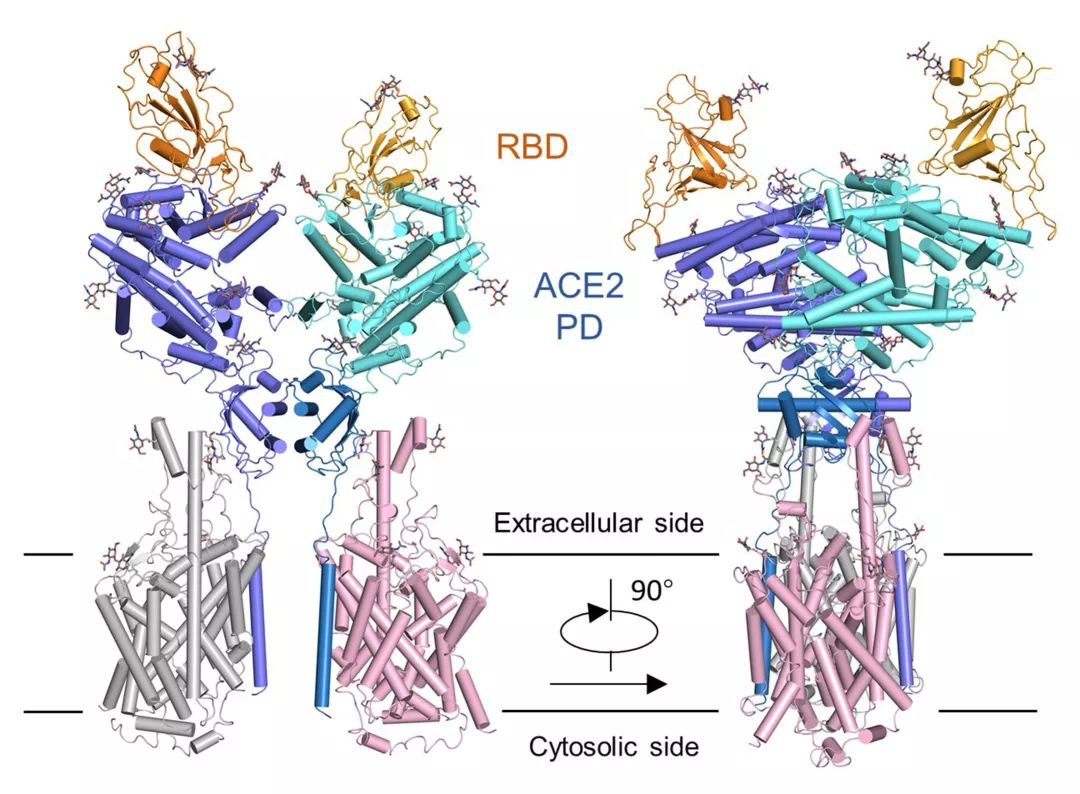
周强实验组发现,在形态上,新冠病毒的S蛋白像一座桥横跨在ACE2表面,又像病毒的一只手,紧紧抓住ACE2,这一点与SARS病毒很相似。新冠病毒S蛋白的受体结合结构域与SARS病毒的序列也非常像,相似性达到82%。
进一步分析,研究人员可以看到新冠病毒表面的S蛋白到底是由哪些氨基酸与ACE2相互作用。对比此前已经解析出来的SARS病毒与ACE2的相互作用,新冠病毒S蛋白有一部分氨基酸残基发生了较大改变。这得出了与此前Jason S. McLellan研究组相似的猜测:在ACE2的结合能力上,新冠病毒和SARS不一样,这种结合能力影响了病毒的传染力。
S蛋白与ACE2蛋白
当然,复合物结构能够快速被解析出,这还要得益于近几日各国科学家们对病毒入侵过程中的关键蛋白质——S蛋白和ACE2蛋白的解构,以及成果的及时分享。
· Jason S. McLellan研究组解析出S蛋白结构
其中S蛋白全称为spike glycoprotein(刺突蛋白),它是位于新冠病毒最外层包膜上的糖蛋白,与病毒的吸附和侵入有关。
2月15日,美国卫生总署(NIH)与德克萨斯大学奥斯汀分校Jason S. McLellan研究组在预印版平台bioRxiv发表了研究成果,解析了他们利用冷冻电镜技术分析出的新型冠状病毒表面S蛋白近原子结构。2月19日,该研究成果被《Science》杂志收录并正式刊发。(bioRxiv论文地址:https://www.biorxiv.org/content/10.1101/2020.02.11.944462v1.full)
论文显示,新型冠状病毒是利用高度糖基化的同源三聚体S蛋白进入宿主细胞,即S蛋白经历结构变化将病毒融合进入宿主细胞的细胞膜。此过程包括病毒的S1亚基结合到宿主细胞受体上,引发三聚体不稳定性的发生,进而造成S1亚基脱落S2亚基形成高度稳定的融合后结构。
为了对新型冠状病毒的S蛋白预融合的结构进行解析,他们通过对已经公开的2019-nCoV的序列进行亲和层析和凝胶排阻层析,从而实现体外蛋白纯化,而在收集和处理3207张蛋白图像后,研究者们实现了对蛋白的3D结构重组,获得了3.5埃分辨率、受体可结合状态下的S蛋白结构。
通过该结构分析,作者们发现S1亚基中的RBD(受体结合结构域)经历铰链类似运动,在靠近三聚体的中央部位上,S蛋白中3个RBP(RNA结合蛋白)中的1个会向上螺旋突出从而让S蛋白形成能够轻易与宿主受体ACE2结合。研究者发现,与SARS-CoV的S蛋白结构相比,新型管冠状病毒中RBD结构更靠近三聚体的中央部位,因此传染性更强。
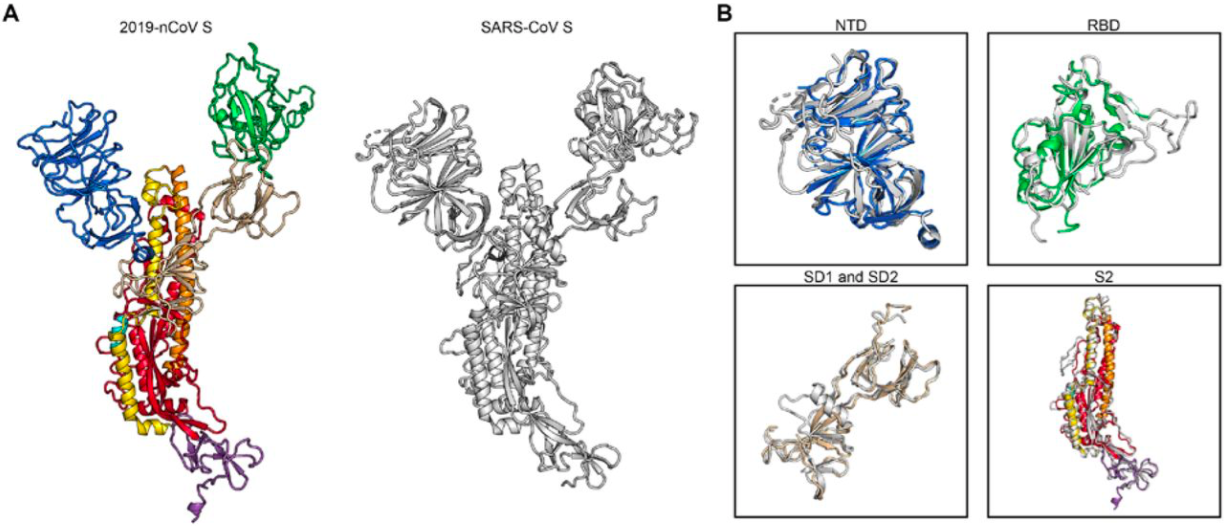
随后,该研究作者就将把这一结构的原子“坐标”数据发送给世界各地数十个研究小组,这些研究小组正致力于研发针对新型冠状病毒的疫苗和药物。
· 周强实验室解析出ACE2蛋白的全长结构
而ACE2全称为“血管紧张素转化酶2”,是人体内一种参与血压调节的蛋白,广泛存在于肺、心脏、肾脏和肠道等部位。对此,西湖大学特聘研究员陶亮解释,“如果把人体想象成一间房屋,把新冠病毒想象成强盗,那么,ACE2就是这间房屋的’门把手’;S蛋白抓住了它,病毒从而长驱直入闯进人体细胞。”
2月19日,西湖大学周强实验室在预印版平台bioRxiv上线了自己的研究成果,他们利用冷冻电镜技术成功解析此次新冠病毒的受体——ACE2的全长结构。(关于该研究的具体细节,可以查看https://www.im2maker.com/news/20200219/d9amfteftgwx30z5.html)
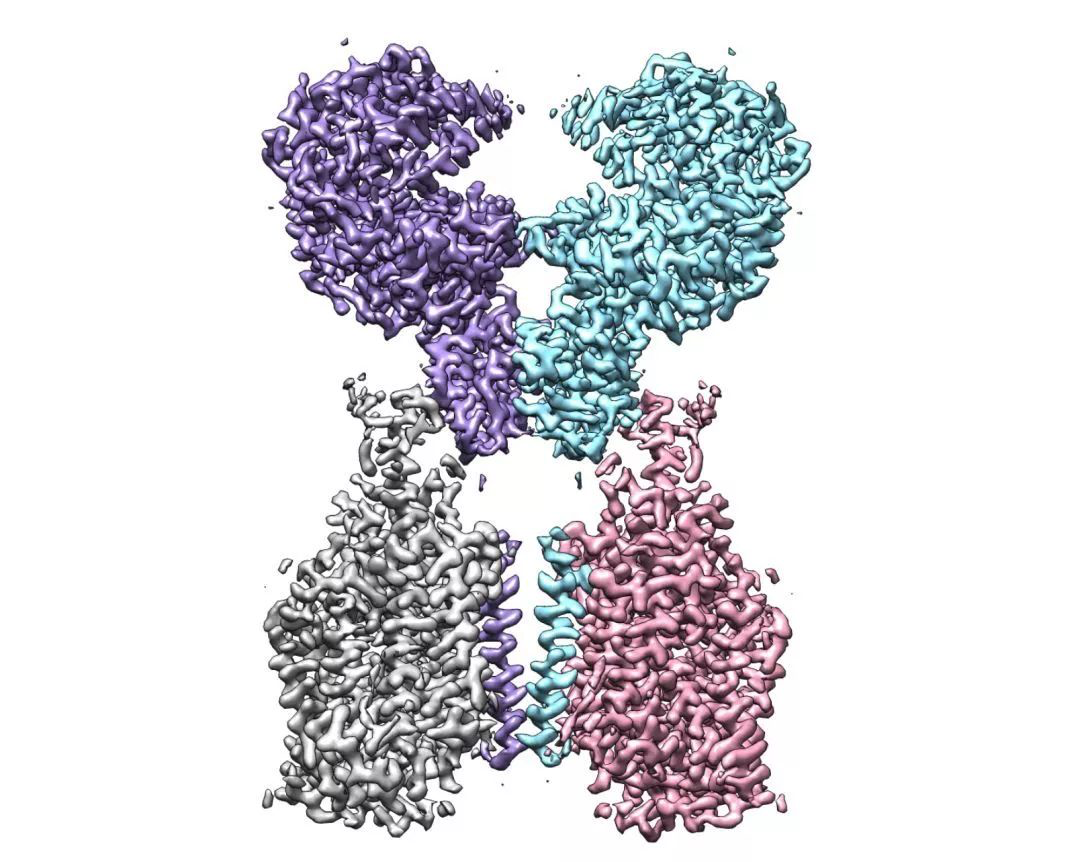
最后
不仅仅是周强、Jason S. McLellan和齐建勋研究组,在结构分辨率上,晶体学家们也在紧锣密鼓地攻坚同一问题,力求获得更高的分辨率。
在昨晚,中国科学院微生物研究所齐建勋研究团队也将2.5埃的类似晶体结构发布在国家微生物科学数据中心。这一系列成果互相验证、互为补充,在原子水平揭示了新冠病毒入侵人体细胞的第一步。
此外,清华大学王新泉和张林琦课题组利用昆虫细胞体系表达和纯化了新冠病毒 RBD和人ACE2胞外结构域,成功生长出新冠病毒 RBD-ACE2复合物的晶体,并利用上海光源BL17U线站收集了分辨率为2.45埃的衍射数据,解析其三维空间结构。
对于既有的一系列研究,张林琦教授表示意义重大,“病毒如何进入细胞,这一步非常关键。因此,在原子分辨率水平极其清晰地看新冠病毒与受体复合物作用界面的信息,对了解新冠病毒进入细胞或者感染细胞的机制,具有重要的指导意义。”
当然,距离研究出疫苗,这些工作还远远不够,因此这也需要更多科学家投入到后续的研究中。
最后,记得关注微信公众号:镁客网(im2maker),更多干货在等你!
硬科技产业媒体
关注技术驱动创新
 水生物科学细胞酶
水生物科学细胞酶 
 微信ID:im2maker
微信ID:im2maker 长按识别二维码关注
长按识别二维码关注